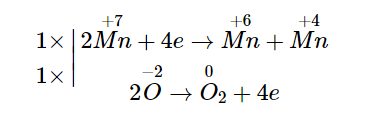KMnO4 → K2MnO4 + MnO2 + O2 là phương trình điều chế oxi từ KMnO4, bài viết này sẽ giúp các bạn viết và cân bằng chính xác phương trình, cũng như biết cách vận dụng làm các dạng bài tập câu hỏi liên quan đến KMnO4.
Mục lục bài viết
1. Cân bằng phản ứng nhiệt phân KMnO4 → K2MnO4 + MnO2 + O2:
Suy ra: 2KMnO4 → K2MnO4 + MnO2 + O2
Phản ứng hóa học trong trường hợp này là phản ứng nhiệt phân permanganat kali (KMnO4). Khi KMnO4 bị nhiệt phân ở điều kiện thích hợp, nó sẽ phân giải thành các sản phẩm sau:
+ K2MnO4 (manganat kali) : là một hợp chất kali và mangan.
+ MnO2 (manganđiôxit): là một dạng khác của mangan, là chất rắn màu đen.
+ O2 (khí oxi): là một trong những thành phần chính của không khí.
KMnO4 chuyển từ dạng dung dịch sang dạng các sản phẩm khác nhau. K2MnO4 là một dung dịch muối màu tím của manganat kali, MnO2 là chất rắn manganđiôxit màu đen, và O2 là khí oxi. Phản ứng nhiệt phân này là một phản ứng tự phản ứng, tức là không cần thêm chất xúc tác ngoại trừ nhiệt độ đủ cao để phản ứng diễn ra. Hiện tượng quan sát được trong phản ứng này bao gồm mất màu của KMnO4 và sự hình thành của các sản phẩm mới như K2MnO4, MnO2 và khí oxi (O2). Bản chất của KMnO4 trong phản ứng này là chất oxi hoá mạnh và thông thường khí oxi được điều chế bằng cách phân huỷ những hợp chất giàu oxi và ít bền đối với nhiệt như KMnO4.
2. Tính chất của KMnO4:
Tính chất vật lí
KMnO4 tan tốt trong nước (ở 250C, độ tan của KMnO4 là 7,64 g). Ngoài ra, KMnO4 còn tan trong các dung môi hữu cơ phân cực như etanol, metanol, axeton… và oxi hóa dần các dung môi đó. Thuốc tím nóng chảy ở 2400C và bị phân hủy tạo thành oxi.
Trong điều kiện bình thường, KMnO4 khá nhạy cảm khi tiếp xúc với các chất hữu cơ, cụ thể, nó sẽ dễ bị phân hủy thành MnO2 và oxy (O2). Thuốc tím kali pemanganat cũng có khả năng oxi hóa cả các chất hữu cơ và các chất vô cơ, như axit oxalic, sulfat, clo, nitrit và nhiều loại hợp chất khác. KMnO4 là một chất oxi hóa mạnh và có thể gây ra nguy hiểm nếu được sử dụng một cách không đúng cách hoặc không đúng liều lượng. Nó có thể gây bỏng da và mắt, và khi hít phải sẽ gây kích thích đường hô hấp.
Kali pemanganat (KMnO4) là một một chất oxy hóa rất mạnh. Chất này có khả năng oxy hóa các chất khác trong một loạt các phản ứng hóa học. Khi phản ứng oxi hóa khử xảy ra với thuốc tím, khả năng oxi hóa của KMnO4 được thể hiện khi dung dịch màu tím sẫm bị oxy hóa và chuyển thành màu không màu, sau đó chuyển thành dung dịch màu nâu. Phản ứng này có thể thực hiện trong môi trường axit hoặc môi trường bazơ. Trong môi trường axit, ion MnO4- chuyển thành ion Mn2+, còn trong môi trường bazơ, ion MnO4- chuyển thành ion MnO42-.
Ở điều kiện bình thường, KMnO4 là một hợp chất có độ bền cao. Tuy nhiên, khi nó được đun nóng, nó sẽ phân hủy. Quá trình nhiệt phân kali pemanganat sẽ tạo thành MnO2, kali manganat và giải phóng oxy theo phương trình: KMnO4 → K2MnO4 + MnO2 + O2.
KMnO4 có tính oxi hóa mạnh do Mn có số oxi hóa +7 cực đại. Tính oxi hóa của KMnO4 còn phụ thuộc vào môi trường tiến hành phản ứng, thông thường tính oxi hóa của KMnO4 mạnh nhất trong môi trường axit, sau đó là môi trường trung tính và cuối cùng là môi trường bazơ.
– Trong môi trường axit: KMnO4 bị khử thành Mn có số oxi hóa +2. Nó có khả năng oxi hóa được các halogenua (trừ F-), các muối sunfua tan và H2S, H nguyên tử và các chất hữu cơ và các chất khử khác.
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
4KMnO4 + 5C2H5OH + 6H2SO4 → 5CH3COOH + 2K2SO4 + 4MnSO4 + 11H2O
2KMnO4 + 10KI + 8H2SO4 → 6K2SO4 + 2MnSO4 + 5I2 + 8H2O
2KMnO4 + 10FeSO4 + 8H2SO4 → 5Fe2(SO4)3 + 6K2SO4 + 2MnSO4 + 8H2O
2KMnO4 + 5H2C2O4 + 3H2SO4 → 10CO2 + K2SO4 + 2MnSO4 + 8H2O
– Trong môi trường trung tính: KMnO4 bị khử thành Mn có số oxi hóa +4 (MnO2). KMnO4 có thể oxi hóa được H2S, etanol …
2KMnO4 + 3H2S → 2MnO2 + 3S + 2KOH + 2H2O
2KMnO4 + 3CH3CH2OH → 2MnO2 + 3CH3CHO + 2KOH + 2H2O
– Trong môi trường bazơ: KMnO4 bị khử thành Mn có số oxi hóa + 6
2KMnO4 + K2SO3 + 2KOH → 2K2MnO4 + K2SO4 + H2O
2KMnO4 + KCN + 2KOH → 2K2MnO4 + KOCN + H2O
– Trong điều kiện nhiệt độ cao: KMnO4 tự phân hủy sinh ra oxi, ngoài ra nó oxi hóa mạnh nhiều phi kim và các chất khử các
2KMnO4 → K2MnO4 + MnO2 + O2
2KMnO4 + C → K2MnO4 + MnO2 + CO2
2KMnO4 + S → K2MnO4 + MnO2 + SO2
10KMnO4 + 4P → 5K2MnO4 + 5MnO2 + 2P2O5
3. Ứng dụng của KMnO4:
– Kali Pemanganat (thuốc tím) dùng trong xử lý nước thải y tế:
Kali pemanganat (KMnO4) là một chất oxi hóa mạnh được sử dụng trong xử lý nước thải y tế để loại bỏ các chất hữu cơ, vi khuẩn, virus và các hợp chất độc hại khác. Kali pemanganat có thể được sử dụng trong quá trình xử lý nước thải y tế theo các cách sau:
Kali pemanganat có thể được sử dụng để xử lý sơ bộ qua các quy trình tiếp theo như bộ lọc hoặc hệ thống xử lý sinh học. Trước khi vào hệ thống xử lý chính thức, nước thải y tế sẽ được xử lý bằng kali pemanganat để loại bỏ các tạp chất, tạo điều kiện thuận lợi cho các quá trình xử lý tiếp theo hoạt động hiệu quả hơn. Thuốc tím Kali pemanganat cũng được sử dụng để khử trùng nước thải y tế nhờ tác động tiêu diệt vi khuẩn và virus có trong nước thải. Điều này giúp ngăn chặn sự lây lan của các bệnh truyền nhiễm, tạo một nguồn nước an toàn đảm bảo cho sức khỏe. Nước thải y tế vốn chứ rất nhiều các hợp chất độc hại và Kali pemanganat có thể được sử dụng để loại bỏ các hợp chất này. Thuốc tím lúc này sẽ có khả năng oxi hóa các hợp chất hữu cơ, các chất độc hại để tạo thành các hợp chất không độc hại, giúp giảm thiểu nguy cơ gây hại cho sức khỏe và môi trường.
– Kali Pemanganat (thuốc tím) dùng trong lĩnh vực thủy sản:
Kali pemaganat là một công cụ hỗ trợ rất nhiều cho các hộ chăn nuôi thủy sản. Cụ thể, dưới đây là một số ứng dụng của kali permanganat trong lĩnh vực thủy sản: Kali permanganat có khả năng tiêu diệt một số loại vi khuẩn, virus và tảo độc, giúp đảm bảo cho cho sức khỏe, sự sinh sản của cá, thủy sản và động vật thủy sinh khác. Hợp chất này cũng được sử dụng để điều trị các bệnh nấm và vi khuẩn thủy sản. Nó có thể tiêu diệt các loại vi khuẩn gây bệnh như Aeromonas, Pseudomonas, Vibrio và nhiều loại nấm. Kali permanganat còn giúp làm sạch và khử mùi hôi trong nước hồ cá do có thể tăng oxy hóa trong nước bằng cách phân hủy hữu cơ.
– Loại bỏ chất vô cơ trong nước
Một trong những ứng dụng quan trọng của kali pemanganat là trong việc loại bỏ các chất vô cơ khỏi nước. Các chất vô cơ này bao gồm những khoáng chất như sắt, mangan, sulfat và nhiều ion kim loại khác. Các chất vô cơ này có thể gây ô nhiễm nước và có hại cho sức khỏe con người. Kali pemanganat được sử dụng để loại bỏ các chất vô cơ này trong nước bằng cách oxy hóa chúng thành các chất không độc hại, nhưng đòi hỏi các điều kiện đặc biệt và quá trình xử lý phức tạp. Quá trình này bao gồm thêm kali pemanganat vào nước cần xử lý, và sau đó đợi cho phản ứng diễn ra và các chất vô cơ bị oxy hóa hoàn toàn. Sau đó, các chất được loại bỏ bằng cách sử dụng các phương pháp khác nhau.
Nên lưu ý KMnO4 là một loại chất gây kích ứng mạnh cho mắt và da của con người khi nó ở dạng đậm đặc. Nó có thể phản ứng với nhiều chất khử hoặc chất hữu cơ và dễ cháy. Vệc sử dụng KMnO4 có thể để lại các vết trên da hoặc các mô, do hoạt động bằng quá trình oxy hóa phá hủy trên tất cả các chất hữu cơ. KMnO4 là một chất hóa học nguy hiểm, ngay cả khi tiếp xúc trong thời gian ngắn cũng có thể gây khó chịu. Tuy nhiên, bằng cách tuân thủ vệ sinh cá nhân và thực hiện các biện pháp phòng ngừa thích hợp trong việc xử lý thuốc tím, người ta có thể tránh được các mối nguy hiểm cho sức khỏe.
Nếu hít phải, thuốc tím kali pemanganat có thể gây kích ứng mũi và họng. Nghiêm trọng hơn, nó có thể ảnh hưởng đến hệ hô hấp và gây ho, khó thở và phù phổi. Ngoài ra, chất này còn có thể ảnh hưởng đến gan và thận. Tiếp xúc lâu dài với KMnO4 có thể ảnh hưởng đến khả năng sinh sản. Do đó, nên thực hiện biện pháp bảo vệ cơ thể khi tiếp xúc với chất này, đặc biệt là khi sử dụng trong môi trường làm việc.